在癌症免疫治疗领域,两种主要的工程化T细胞类型已被成功应用于患者:一种基于抗体衍生的抗原识别域(即嵌合抗原受体,CARs),另一种则源自T细胞受体(TCRs)。CARs利用高亲和力的抗原结合区以及共刺激结构域来激活T细胞,但它们仅能对表达相对较高水平抗原的目标细胞起作用。相比之下,TCRs与抗原的亲和力较低,却可以针对仅展示少量抗原分子的目标细胞作出反应。
约翰霍普金斯大学研究团队就融合了以上CART和TCRT的优点,设计了一种新的受体——Co-STAR(共刺激合成T细胞受体和抗原受体):TCR的抗原识别部分被高亲和力的抗体片段取代,而共刺激信号则由驱动NF-κB信号通路的两个模块(MyD88和CD40)提供。装备有Co-STARs的T细胞在体外能够比装有传统CARs和患者来源TCRs的T细胞更有效地杀死低抗原密度的癌细胞。相关成果于2024年7月10日发表在《Science Translational Medicine》上。

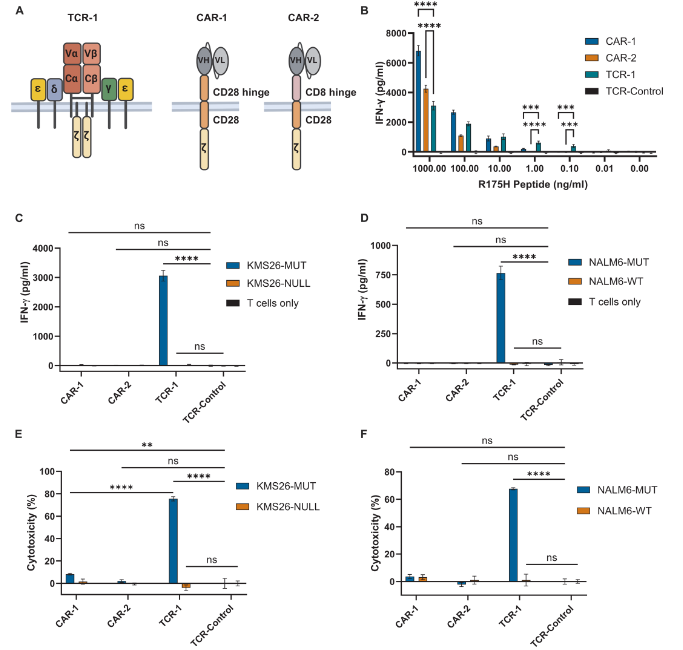
本次研究针对的抗原是一个由含TP53 R175H突变肽段与HLA-A02:01组成的肽-HLA复合物。p53RH抗原是一个极其难搞定的靶点,在癌细胞表面的表达密度非常低,估计每个细胞上约有1.3到2.4个分子。如此低的密度,很适合开发新型T细胞治疗项目。
H2是一种针对p53RH抗原的单链可变片段(scFv),亲和力为86 nM。
构建CAR1:H2-scFv接到一个含有CD28铰链、跨膜和共刺激结构域的常规第二代CAR上,与CD3ζ胞内结构域相连。
构建CAR2:H2-scFv接到一个含有CD8铰链、跨膜和共刺激结构域的常规第二代CAR上,与CD3ζ胞内结构域相连。
构建TCR-1:基于患者来源的AV6/BV11 TCR构建,亲和力为3.5 μM。
和表达抗原的癌细胞共培养,CAR1杀伤极其弱,CAR2不杀伤,TCR1显著杀伤。
TCR T细胞在识别和攻击低浓度抗原的癌细胞方面,确实比传统的CAR T细胞更有优势。
改造CART,提高对低抗原密度的敏感度。
将H2-CARs的scFv(单链可变片段)添加到TCR复合体CD3γ亚单位的N末端,TCRα或TCRβ亚单位的N末端,并以各种方式将新的构建体引入到TRAC位点,消除了内源性TRAC基因的表达,产生了九种不同的T细胞类型,命名为TRuC-1到TRuC-9。
通过改造,许多二级TRuC T细胞能够杀死表达低密度p53RH抗原的目标细胞,scFv片段上的VH和VL的方向也非常重要,有的方向能让T细胞更好地分泌IFN-γ。
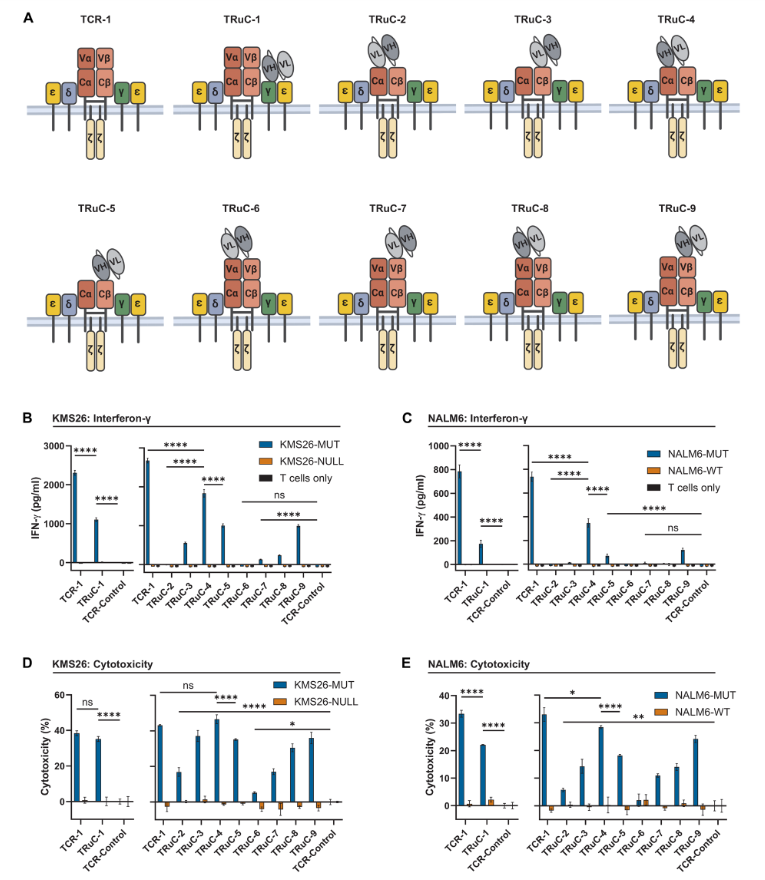
虽然二级TRuC T细胞能够对低抗原密度的目标细胞作出反应,但它们的反应性仍然不如常规TCR。
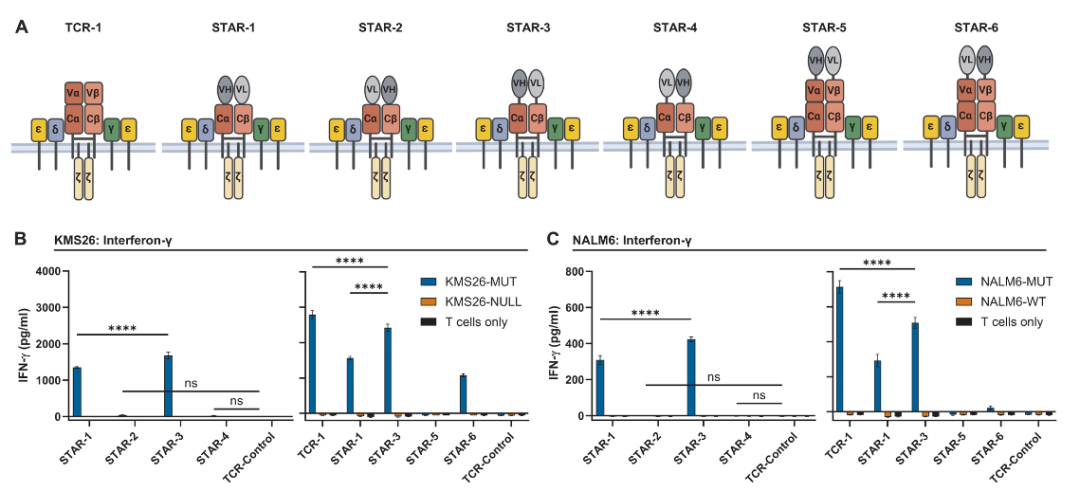
将H2-scFv的VH和VL区域分开,并用它们替换TCRα和TCRβ链的正常识别区域,创建了三级T细胞即STAR-T,分别构造了6种STAR-T。
性能最优的STAR受体设计是STAR-3,在这个设计中,TCR的Vα和Vβ分别被H2-scFv的VH和VL链替换,加上刚性的EAAAK氨基酸序列,与表达天然TCRs的T细胞功能类似。
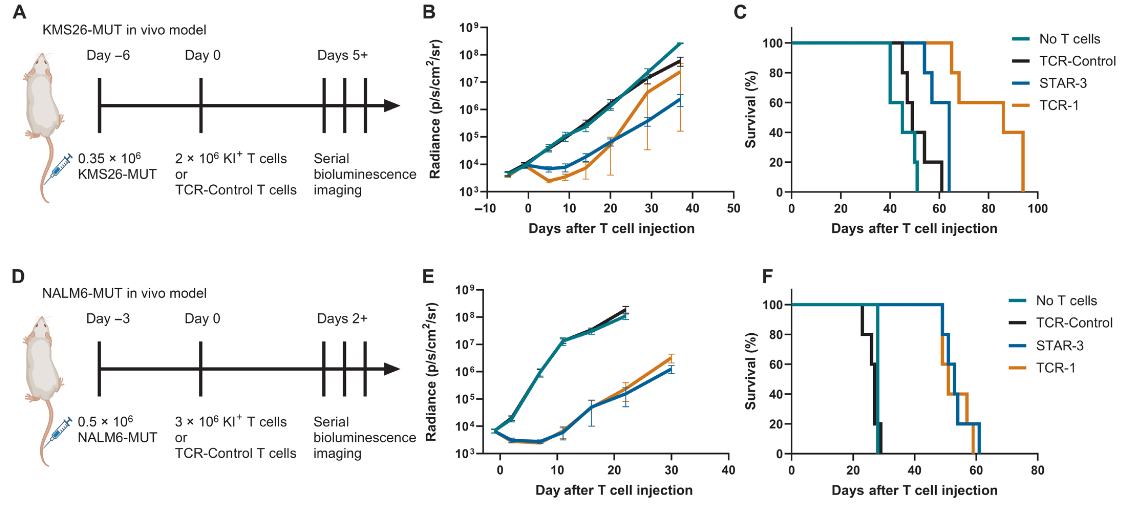
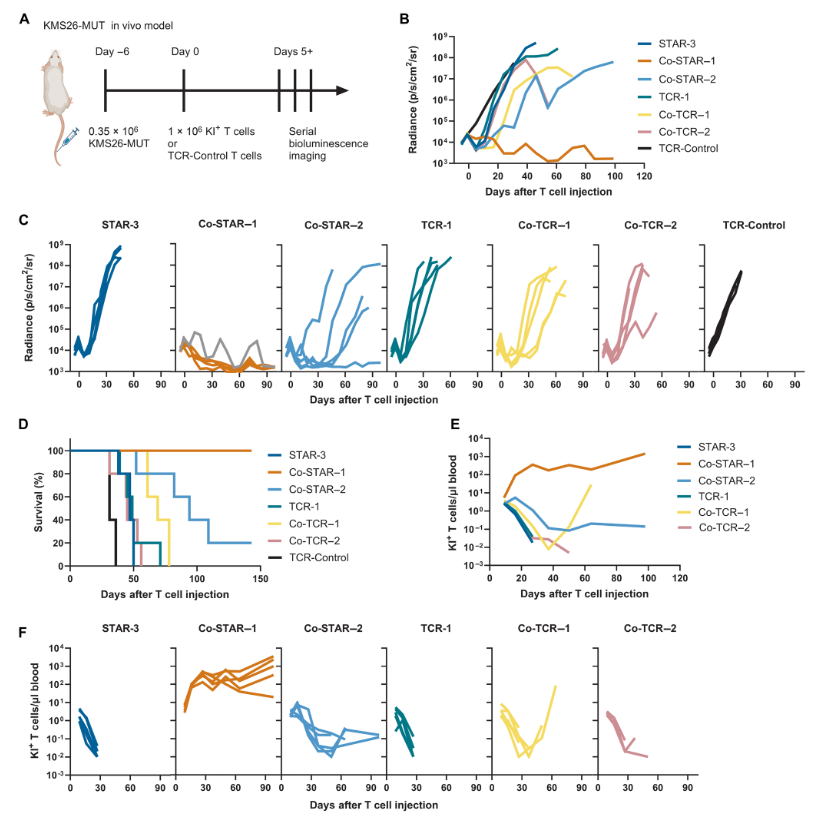
动物模型结果表明,STAR-3 T细胞和TCR-1 T细胞都能够延缓肿瘤的生长,但最终肿瘤还是会复发,小鼠也会因为癌症死亡,因为T细胞在体内不能持续扩增。
总的来说,STAR T细胞在实验室和小鼠实验中都显示出了与自然TCR T细胞相当的识别和攻击低浓度抗原的能力,但在体内持久性和扩增能力上还需要进一步研究和改进。
通过增加共刺激信号来增强T细胞对抗低密度抗原的癌细胞的能力。将组成型性激活的信号分子(如STAT3, STAT5, IL-7Rα)和共刺激分子(如4-1BB, OX40, Fas配体)整合进T细胞中,还有将MyD88-CD40(MC)信号域与TCRβ或Fas的跨膜域相连,产生了九种类型的共刺激TCR(Co-TCR)T细胞。
两种Co-TCR细胞类型脱颖而出:一种是将MC刺激域附着在TCRβ跨膜域上的(Co-TCR–1),另一种是将其附着在Fas跨膜域上的(Co-TCR–2),相比于未修饰的STAR-3或TCR-1 T细胞增强了IFN-γ的产生。
这意味着通过添加共刺激信号,可以增强TCR和STAR T细胞识别和攻击低密度抗原的癌细胞的能力,同时维持对特定抗原的高特异性。
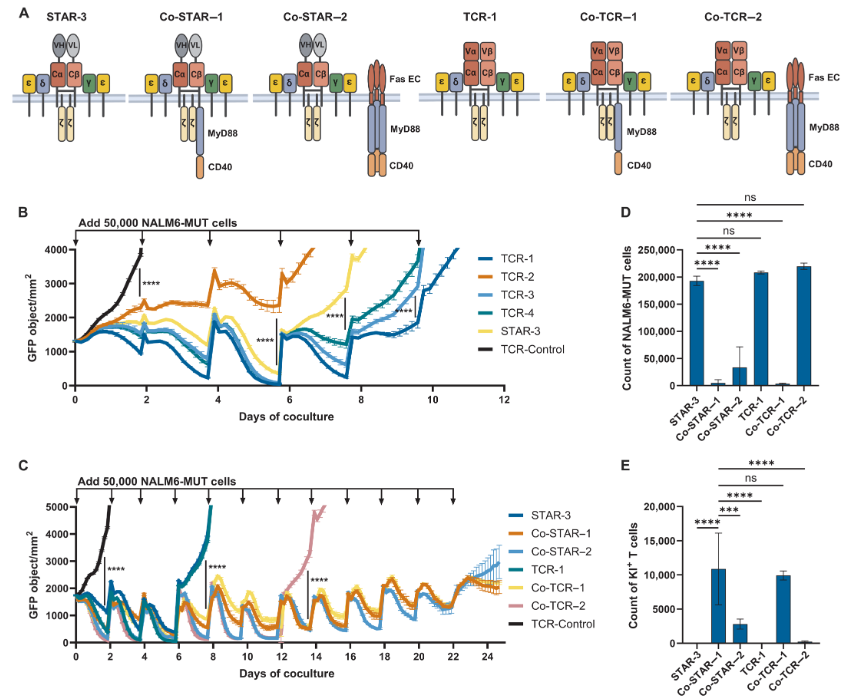
KMS26-MUT小鼠模型显示:没有共刺激的三级T细胞(TCR-1和STAR-3)以及Co-TCR–2 T细胞未能比TCR-Control T细胞更好地控制KMS26-MUT肿瘤。
Co-STAR T细胞比具有相同MC域的Co-TCR T细胞更有效。
当MyD88-CD40域附着在TCRβ上(Co-STAR–1)时,对肿瘤生长的长期控制优于附着在Fas上的情况(Co-STAR–2),并且Co-STAR–1组的小鼠存活率100%。
NALM6-MUT小鼠模型也是类似的结果:Co-STAR–1 T细胞设计最优。
总的来说,Co-STAR–1 T细胞在体内外实验中表现出优于其他T细胞类型的持久控制能力,这主要是由于它们的显著扩增和持久性。
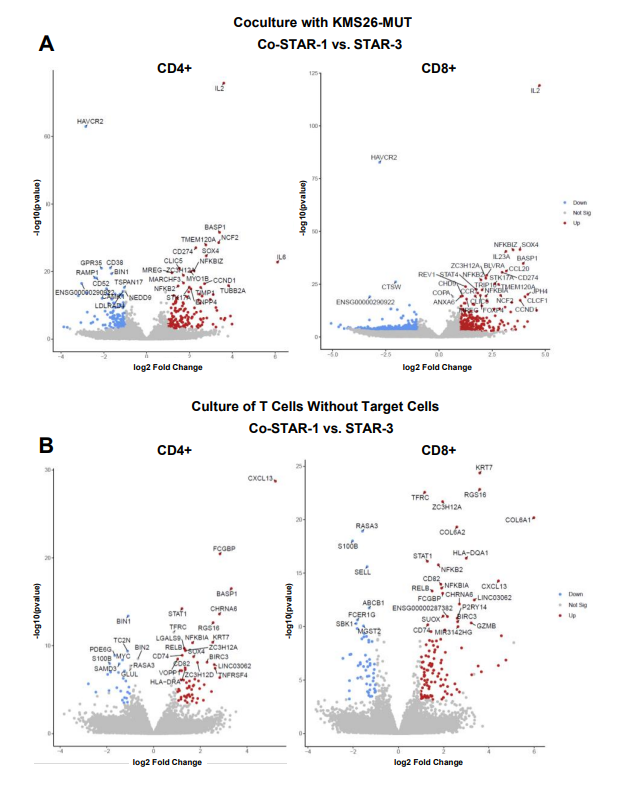
转录组学分析:抗原刺激下,Co-STAR–1 T细胞中和STAR-3 T细胞相比发现了数百个差异表达的基因,IL-2(IL2)编码基因是STAR-3 T细胞相比上调最显著的基因之一。
无抗原刺激下,静态培养,Co-STAR–1 T细胞中和STAR-3 T细胞分别有127和258个基因差异表达,CXCL13编码基因是 Co-STAR–1 T细胞中最显著差异上调的基因之一,转录因子SOX4编码基因也被发现在Co-STAR–1 T细胞中在无抗原的情况下上调。
Co-STAR–1 T细胞在抗原存在下能更好地支持CD4+ T细胞的扩增,这可能对于维持T细胞的多样性及其抗肿瘤反应至关重要。
总之,Co-STAR–1 T细胞不仅在激活状态下能够更有效地分泌多种细胞因子,而且在无抗原刺激的基底条件下也能上调某些基因的表达,这可能有助于它们在肿瘤微环境中的持久性和功能。
该文章,应该说是精彩绝伦,出发点是将T细胞受体(TCR)和嵌合抗原受体(CAR)的优势相结合的可能性,创造出具有高亲和力、源自抗体的受体(来自CAR部分),能特异性地针对甚至只有2个抗原分子这样极低抗原密度的癌细胞。从二级TRuC到三级STAR T,再到四级结构的Co-STAR设计,一步一步解决遇到的现实问题。
文章中,MyD88和CD40提供的共刺激(MC域)使Co-STAR–1和Co-STAR–2 T细胞能在小鼠体内清除平均每个细胞上仅有一到两个pHLA的癌细胞,这远超过了之前在体外或体内使用TCR样CAR研究的最低抗原密度限制。将MC域链接到TCRβ使得Co-STAR–1 T细胞在小鼠体内的丰度比Co-TCR–1 T细胞高出千倍。
文章还研究了轻链和重链的表位顺序、表位接触、CD8和CD28的跨膜共受体区别、T细胞-靶细胞相互作用、额外共刺激以及机械力在T细胞信号传导中的作用,真的是研究数据之大,甚是精彩。
信息来源:公众哈-新药说,作者-HSA
 loading...
loading...